2002年,根据药品管理法及实施条例和国家食品药品监督管理局关于药品认证分级管理的有关规定,省级食品药品监督管理部门应成立药品认证机构。由于河北省机构编制的实际情况,申请成立药品认证机构的审批时间恐不能满足药品认证工作开展的需要,为此,我局利用原河北省医药管理局1995年经河北省编办批准设立但未实际运作的“河北省医药信息交流中心”的批文,按名称变更的程序将其更名为“河北省药品认证咨询中心”,选调干部,调配人员,建立起机构,初步开展工作。2004年,再次按程序变更为“河北省食品药品监督管理局药品审评认证中心”,至此,完成了我局药品认证机构的法律登记手续。
一、编制与机构性质
根据河北省编办的批文规定,河北省食品药品监督管理局药品审评认证中心,人员编制:26人,机构规格:处级,机构性质:经费自理型。
二、职能职责
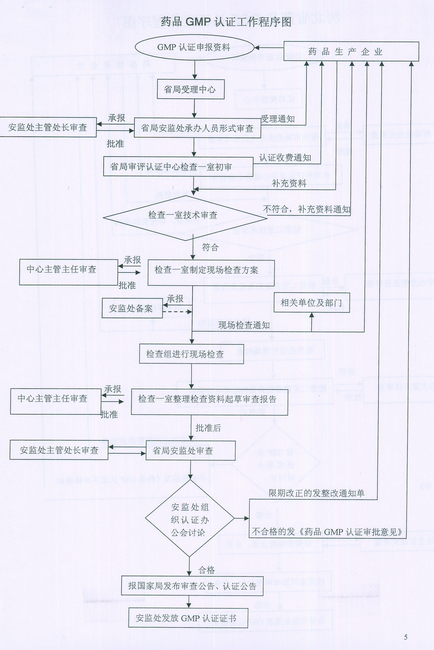
1 、承担药品生产企业GMP认证技术审查和现场检查的组织实施工作。
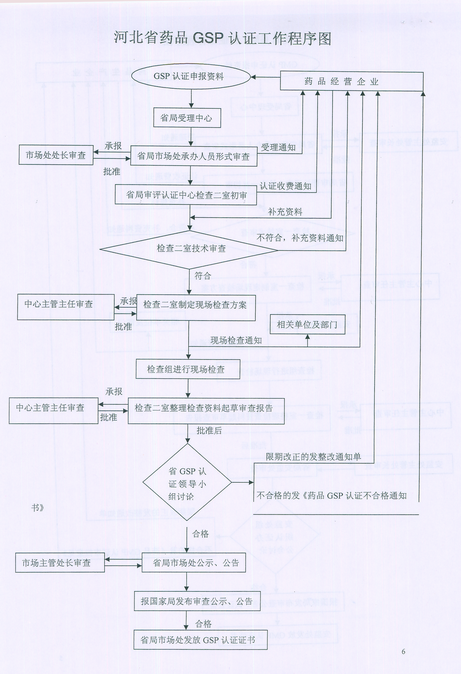
2 、承担药品经营企业GSP认证技术审查和现场检查的组织实施工作。
3、负责药品GMP、GSP检查员的培训与继续教育;负责药品经营企业质量管理人员培训与继续教育。
4 、负责对申请药品研究、生产、经营和使用单位的技术咨询。 5 、负责国内外学术交流工作。
三、内部机构设置
1 、检查一室承办药品 GMP 认证的技术审查和现场检查的组织实施工作:承办省局对药品生产企业跟踪检查,飞行检查的组织实施工作:负责药品生产企业有关药品认证设计的图纸论证工作:负责药品 GMP 检查员的培训与继续教育工作。
2 、检查二室承办药品 GSP 认证的技术审查和现场检查的组织实施工作:负责药品经营企业质量管理人员的培训与继续教育工作:负责药品 GSP 检查员培训与继续教育工作。
3 、综合办公室协调中心日常行政事务,负责文电处理、档案、资产、财务、税务、后勤管理等工作:负责党务、人事、劳资、社保等管理工作。
四、药品认证程序
1 、坚持行政监督与技术监督分离原则,权责清晰。受理由省局政务大厅统一受理,转送相关职能处室;职能处室形式审查后转送认证中心;认证中心技术审查和现场检查后提交办公会审议:审议通过由职能处室发证。
2 、坚持集体负责制。省局成立 GMP 、 GSP 认证领导小组,分别由主管安监和市场的副局长担任领导小组组长,成员由相应处室人员和中心相应人员组成。领导小组根据中心提交的现场检查材料,不定期召开审批办公会集体审议,办公会由领导小组组长 ( 副局长 ) 主持,听取认证中心对认证企业现场检查情况的汇报,听取职能处室对该企业生产 ( 经营〉情况的汇报,必要时通知检查组组长到会详细汇报现场实际情况。根据讨论结果,作出审批结论。现场检查组对检查结果现场不做结论,只如实记录缺陷项目及实际情况。
3 、坚持公示制度。除对拟通过认证的企业按规定在网站公示外,还采取飞行检查的组织方式,在认证企业张贴告示,公布检查组成员名单和联系方法,方便企业职工举报和对检查组的监督。
五、认证过程中的廉政建设
为加强药品认证过程的廉洁白律,防止商业贿赂发生,我们重新制定了认证纪律、检查员选选办法等规定,最突出地是将认证全过程置于纪检监察的监督之下,省纪委驻局纪检监察组可以采取混合编组、跟踪检查以及事后抽查等多种形式对认证检查实施防腐败监督。根据当前形势,自去年4月以来,基本采用混合编组的方式实施。纪检监察人员作为检查组成员参加检查。其次,我们改变了检查费用的使用方式,原来我们采取了国家局药品认证特别是GSP认证的方式,按260元/人天标准,将检查费用由中心转帐至认证企业,则由企业负责检查组的接待。为了澄清与企业的关系,在“不坐企业车,不吃企业饭,不住企业店”的原则下,我们改为按360元/人天的标准由认证中心直接支付结算,由观察员负责接待。通过以上措施,取得良好的效果,迄今为止,纪检监察部门反馈的信息是未接获一例有关认证过程不廉洁问题的投诉或举报。
六、财务收费情况
按照财政部、发改委的有关文件,我局向省财政厅多次申请药品认证收费许可,省财政由于种种原因,未曾回复。为了不贻误工作。我们向省物价局申请了收费许可证,收费名义为“认证服务费”。收费范围:涉企;收费标准:自定。依据财政部、发改委关于 GMP 收费标准的文件,目前,我们 GMP 收费标准为:基本费 28000 元。GSP批发企业收费基本标准为 15000 元,零售连锁企业20000元,零售企业(城镇) 2000 元 ,( 农村 )1000 元。由于系服务类收费,中心按国家有关规定依法交纳各项税费。
版权所有 国家药品监督管理局食品药品审核查验中心 未经许可禁止转载或建立镜像
![]() 京公网安备 11010202007695号 京 ICP 备 09098178 号
京公网安备 11010202007695号 京 ICP 备 09098178 号
地址:北京市大兴区旧宫镇广德大街22号院中科电商谷C区一区5号楼 邮编 100076 联系电话:68441000 传真:68441300

【微信公众号】
