2019年度信息公开工作年度报告
根据《中华人民共和国政府信息公开条例》有关规定,结合2019年度国家药品监督管理局食品药品审核查验中心信息公开实际,编制本年度报告。报告内容包括概况、信息公开平台建设、信息主动公开情况、咨询和投诉的办理情况、主要问题和改进措施等。本报告所列数据的统计期限自2019年1月1日至2019年12月31日止。
如对本报告有疑问,请与国家药品监督管理局食品药品审核查验中心信息管理处联系(地址:北京市西城区文兴街一号院3号楼北矿金融大厦7层;邮政编码:100044;咨询电话:010-68441187)。
一、概况
2019 年,我中心按照《中华人民共和国政府信息公开条例》、《政府网站发展指引》以及《2019年国家药品监督管理局直属单位网站评估指标》要求,加强信息平台建设,整合办事服务功能,增加专栏设置,深化重点领域信息公开,不断提升信息公开质量。
二、信息公开平台建设
(一)中英文网站。截至2019年12月31日,中文网站共设置50个栏目,其中动态要闻类栏目6个,公告信息类栏目13个,政策法规类栏目1个,数据查询类栏目8个,专题专栏类栏目10个,机构职能类栏目1个,互动交流类栏目3个,办事服务类栏目8个。英文网站建立6个栏目,其中动态要闻类栏目3个,机构职能类栏目1个,政策法规类栏目2个。

核查中心网站首页
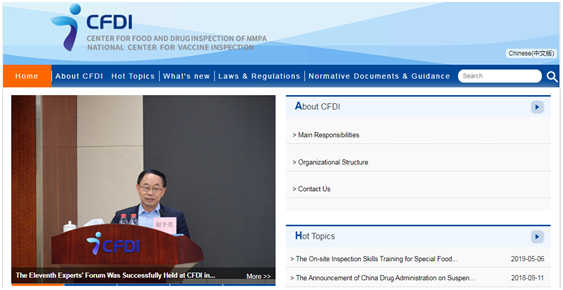
英文网站首页
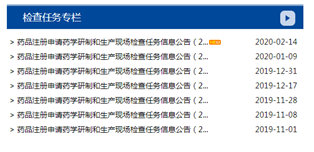
1. 为落实《药品管理法》信息公开的要求,更好地服务于药品注册申请人,中心网站于2019年增设 “检查任务专栏”、“ 医疗器械检查专栏”(如下图所示)。定期公告我中心发起的药品注册申请检查任务情况,提醒注册申请人做好接受检查的准备。

2. 网上咨询回复内容按照药物临床试验现场检查,医疗器械临床试验现场检查,药物非临床研究现场检查,化学药品生产现场检查,中药生产现场检查,生物制品生产现场检查,医疗器械生产现场检查,化妆品研制、生产现场检查,食品生产现场检查等分类显示,便于查询同类问题。

3. 将网上办事栏目的在线申请、在线填报、在线预约等内容整合进办事指南栏目,原有栏目及内容保持不变,方便用户从不同栏目入口办理事务。

4. 在政策法规栏目下增加临床试验数据核查、化学仿制药注射剂注射生产现场检查子栏目;将网站首页一致性评价和指导原则两个栏目调整到政策法规栏目下,作为子栏目;撤销数据可靠性栏目。栏目调整后,网站首页布局相应调整。

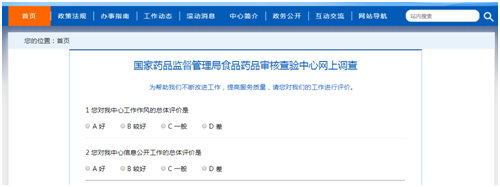
5. 在网站首页增加网上调查栏目,调查内容主要围绕中心检查工作、信息公开等方面。通过网上调查收集公众意见和建议,促进中心综合能力提升,更好的服务大众。
6. 完善机构职能公开,在中心简介栏目左下角公开中心邮箱、地址、邮编、电话等,方便公众查看。在网页底部,增加中心电话总机、传真。

7. 对网上搜索结果进行分类显示,提示信息所在栏目,方便查询同类信息。
8. 在网上咨询、网上投诉、在线预约等填报中,增加安全校验功能,防止恶意批量操作,提高网站安全性。
2019 年,中英文网站浏览量共442万次,比2018年增加21%。
(二)微信公众号。截至2019年12月31日,“CFDI检查核查之窗”微信公众号已建立三大板块15个栏目,其中动态要闻类栏目1个,公告信息类栏目3个,政策法规类栏目3个,专题专栏类栏目4个,机构职能类栏目3个,办事服务类栏目1个。从2016年12月6日上线至2019年12月31日,关注人数达到3万余人,其中2019年新增关注5763人。

微信公众号二维码展示
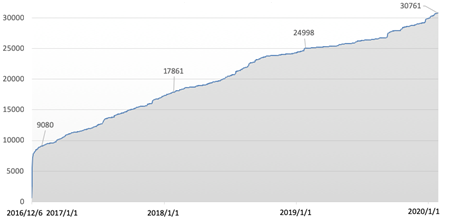
微信公众号关注人数
(三)展示系统。2019年,根据业务工作调整,对接待室展示查询一体机内容进行了更新,保证相关内容与网站同步,为中心来访人员提供给准确可靠的信息。
三、信息主动公开情况
(一)进一步完善相关制度。修订发布了《网站信息发布管理程序》和《微信公众号信息发布管理程序 》 ,规范信息收集、录入、使用过程的管理,确保信息发布准确、及时、规范、有效。
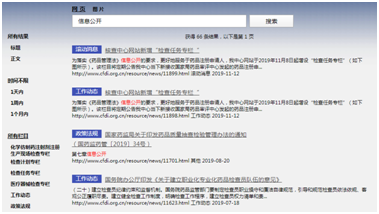
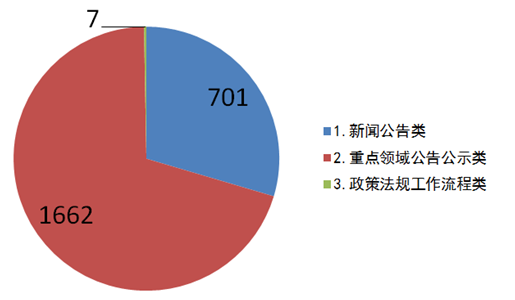
(二)加大主动公开力度。2019年1月1日至12月31日,中文网站共计主动公开信息2370条,相比2018年增长82%。其中,新闻公告类701条、重点领域公告公示类1662条,政策法规工作流程类7条。英文网站发布信息16条。
核查中心网站信息发布总体情况
(三)加强重点领域信息公开。
2019 年,总计发布公告公示类信息6条,其中药物非临床研究质量管理规范认证公告1条,药物临床试验机构资格认定检查公告1条,药物临床试验数据现场核查计划公告4条。
化学仿制药注射剂注册生产现场检查专栏、检查任务专栏、医疗器械检查专栏、临床试验数据核查专栏、飞行/跟踪检查专栏、境外检查专栏、检查计划专栏,共发布及转发总局相关热点信息126条。
发布现场检查/核查预告和公告信息1530条,其中药品注册生产现场检查预告和公告490条、药物GLP现场检查预告和公告46条、药物临床试验数据现场核查预告和公告994条。
(四)维护相关查询数据库。2019年,中心继续对已有数据库进行维护,并补充新增药物非临床研究质量管理规范认证公告、药物临床试验资格认定检查公告内容。截至2019年12月31日,中心网站共计主动公开公告查询数据库5个,数据量为23429条,其中药品GMP认证公告20588条;中药材GAP检查公告176条;药物非临床研究质量管理规范认证公告118条;药物临床试验资格认定检查公告971条;药品GMP认证审查公示数据1576条。
(五)持续提升公众号信息发布质量。截至2019年12月31日,公众号共推送信息484次,发布信息1097条,信息总阅读人数为91万人,信息总阅读量为196万次。2019年,共推送信息118次,信息发布207条,信息阅读人数为255645人,阅读量为368409次,单条信息阅读量最高达到20845次,相比2018年,平均每条信息阅读量增加46%。
按信息所属栏目分类,2019年主要栏目信息发布数量为:监管处罚66条,检查动态43条,检查研究31条,检查计划21条,监管政策14条,征求意见12条,检查公告12条,年度报告7条,其他信息1条。与2018年相比,信息发布内容减少了监管处罚所占比例,增加了检查动态、检查研究、检查计划等信息占比。
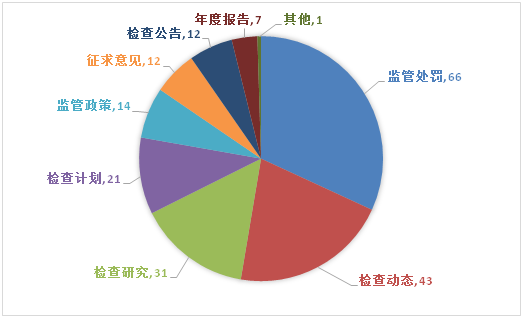
微信公众号各栏目信息发布量
四、咨询和投诉的办理情况
(一)网上咨询。2019年全年共收到网上咨询问题771件,其中有效咨询708件,相比2018年上升5.8%;无效咨询63件,主要原因是问题描述不完整或不清晰。有效咨询中,完成回复371件,回复率为52%,其中80件涉及药品生产及中心业务等方面的共性问题(或关注度较高问题)已发布在网站上,189件一般性问题以邮件或短信方式回复咨询者。
(二)网上投诉及办理情况。
2019 年全年共接到投诉19件,其中有效投诉8件,比2018年减少了77%;无效投诉11件,多数为重复投诉,或问题描述不清无法处理。有效投诉中,6件投诉事项不属于中心职能范畴,已转交国家药品监督管理局行政事项受理服务和投诉举报中心处理,2件涉及中心检查事项,均已转中心业务部门处理。投诉举报事项处理率为100%。
(三)网上调查情况。
中心网站于2019年9月25日新增网上调查栏目,用于收集公众对网站提出的意见和建议,提升网站信息公开等工作的服务质量。截至2019年12月31日,中心未收到调查反馈。
(四)在线预约情况
2019 年共收到在线预约信息937条,中心及时对收到的信息进行处理,将预约信息分配给各处室,完成现场沟通工作。
五、主要问题和改进措施
2019 年,中心在突出重点领域信息公开,努力提升公开信息的针对性、及时性和有效性方面取得了明显成效,但面对药品监管、药品检查的新局面新需求,信息公开工作仍存在问题和不足,主动公开力度仍需加大,回应公众咨询有待加强,信息服务质量有待提高。2020年,中心将继续按照《中华人民共和国政府信息公开条例》和国家药品监督管理局有关要求,重点做好以下工作:
(一)加强信息公开平台建设。中心将根据现场检查工作需求,建设以服务药品注册申请人为核心的信息平台——药品注册申请人之窗,实现申请人检查申请提交、现场检查通知查看、缺陷情况查看、检查进度查询、历史检查信息查询等网上办事和信息公开功能,提升检查工作信息化水平。
(二)加大主动公开力度。围绕《药品管理法》、《疫苗管理法》、《药品注册管理办法》、《药品生产监督管理办法》等新法的实施,加强相关检查工作政策宣传,主动公开重点工作领域信息。
(三)加强信息发布管理。加强发布信息内容规范管理,提高信息公开工作精细化程度,提升信息公开工作效率和质量。
国家药品监督管理局食品药品审核查验中心
2020 年3月24日
版权所有 国家药品监督管理局食品药品审核查验中心 未经许可禁止转载或建立镜像
![]() 京公网安备 11010202007695号 京 ICP 备 09098178 号
京公网安备 11010202007695号 京 ICP 备 09098178 号
地址:北京市大兴区旧宫镇广德大街22号院中科电商谷C区一区5号楼 邮编 100076 联系电话:68441000 传真:68441300

【微信公众号】
